1 Einleitung
Alarmierende Statistiken zeigen, dass mehr als die Hälfte aller Krebserkrankungen in Deutschland durch eine falsche Ernährung bedingt sind.[note]Literatur 1, 96[/note] Was bedeutet es nun aber für diese erschreckende Tatsache, wenn mehr bekannt wäre, dass viel Tod und Leid durch Krebs durch geeignete Prävention vermieden werden könnten? Wir hören gerade viel über zu dicke Kinder, Diabetes und ein sich abzeichnendes Gesundheitsdesaster durch Bewegungsmangel und falsche Ernährung. Hier wäre der Staat gefordert, Abhilfe zu schaffen und eine effektive Gesundheitslehre mit geeigneten Präventionsmaßnahmen in die Kindergärten und Schulen als Pflichtfach einzuführen, ein permanentes Gesundheitstraining sozusagen, wie ich dies bereits in meinem Buch „Gesundheit aktives Aufgabenfeld“ schon 1986 gefordert habe.[note]Literatur 96[/note]
Glücklicherweise konnte jetzt wissenschaftlich belegt werden, dass im Gemüse und besonders bei den so genannten Kreuzblütlern oder Kohlgemüse sehr viele Stoffe mit einer antikarzinogenen Wirkung vorkommen. Die Stoffe, die in einigen dieser Pflanzenfamilie gefunden wurden, unterstützen die körpereigenen Stoffwechselwege und Entgiftungsmechanismen, so dass die immer häufiger in unserer Nahrung, im Wasser und in der Luft vorkommenden Karzinogene besser und vollständiger ausgeschieden werden können.
Grünkohl, Broccoli, Blumenkohl und andere Kreuzblütler enthalten alle gesundheitsfördernden sekundären Pflanzenstoffe. Es konnte gezeigt werden, dass diese einzigartigen Stoffe die Entstehung und die Progression von Kolon-, Brust-, Prostata-, Schilddrüsen-, Zervix- und anderen Karzinomen positiv beeinflussen können.[note]Literatur 1-16[/note] Die natürlichen Pflanzenstoffe beeinflussen auch den Östrogenstoffwechsel bei beiden Geschlechtern. Das macht sie zu einzigartigen Stoffen einer jeden Präventivstrategie – dadurch, dass sie den täglichen gesundheitsschädlichen Anschlägen durch karzinogene Stoffe entgegenwirken:
2 Glucosinolate — gesunde Pflanzenstoffe aus Kohlsorten
Glucosinolate sind eine Gruppe von scharfen, schwefelhaltigen Bestandteilen, die früher auch als Vitamin U bezeichnet wurden. Sie dienen den Pflanzen zur Abwehr von Mikroorganismen, z. B. Bakterien und Schimmelpilze und schützen sie auf diese Weise vor Krankheiten. Glucosinolate bilden sich, wenn die Pflanzenzellen z. B. bei der Zubereitung zerstört werden. Bei den dann folgenden Abbauprozessen entstehen daraus weitere hockaktive Stoffe. Als gemeinsames Strukturprinzip enthalten Glucosinolate eine Hydroxiaminogruppe und zwei Schwefelatome, einmal als Sulfonsäurerest und weiterhin als Thioglucopyranosid.
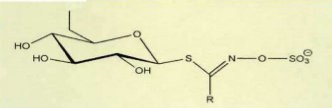
In den Isothiocyanaten bleibt das organische Schwefelatom erhalten, das anionische Sulfat wird abgespalten. Es gibt aber auch Isothiocyanate mit einer weiteren Thiogruppe wie Sulforaphan aus Broccoli-Sprossen oder dessen olefinisches Derivat Sulforaphen, das in Rettich- und Radieschensamen vorkommt. Indole gehören ebenfalls zu den Abbauprodukten von Glucosinolaten und sind pflanzlicher Wachstumshormone. Eine spezielle Form ist das Indol-3Carbinol, oft als 13 C abgekürzt. Daraus kann wiederum Diindolylmethan (DIM) gebildet werden (Abb. l). Glucosinolate haben vor allem antioxidative Fähigkeiten. Sie können aber auch wie bereits erwähnt Karzinogene abbauen und so Krebs schützend wirken. Wegen ihrer antikarzinogenen Wirkungen sind besonders interessant:
- Sulforaphan
- Indol-3-Carbinol (I3C)
- Diindolmethan (DIM)
- Thiocyanate
2.1 Glucosinolate – auch für den Menschen gesund
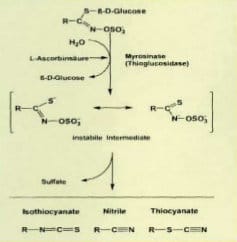
Werden bei der Zubereitung die Pflanzen zerteilt, zerschnitten bzw. zerkleinert, tritt mit Hilfe des Enzyms Myrosinase (ß-Thioglucosidase) ein zersetzender Prozess ein. Dabei entstehen u. a. Glycosilate. Erhitzen der Kohlgemüse verringert die Menge an bioaktiven Stoffen, zerkleinern erhöht sie. Daher ist es gesund, die verschiedenen Kohlsorten roh zu verzehren.
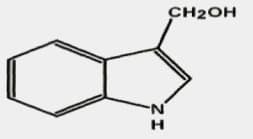
Zu den Abbauprodukten von Glucosinolaten gehören u. a. die Isothiocyanate mit einer speziellen Form, dem Sulforaphan, das interessante gesundheitliche Eigenschaften hat. Indole gehören ebenfalls zu den Abbauprodukten von Glucosinolaten und sind eigentlich pflanzliche Wachstumshormone. Eine spezielle Form ist das Indol-3-Carbinol (I3C) (Abb. 3). Daraus kann wiederum das 10-fach wirksamere Diindolylmethan (DIM) gebildet werden.
Glucosinolate besitzen antioxidative Fähigkeiten und antikarzinogene Eigenschaften. Sie können z. B. schädliche Mykotoxine wie Aflatoxin beseitigen. Isothiocyanate, gehören ebenfalls zu den Abbauprodukten der Glucosinolate. Sie haben ebenfalls antioxiditave Fähigkeiten und können Karzinogene unschädlich machen und u. a. Enzyme hemmen, die beispielsweise zur Entwicklung von Speiseröhren-Krebs beitragen.
2.2 Starkes antikarzinogenes Wirkprofil
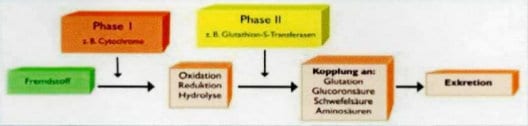
Sulforaphan ein Isothiocyanat kann Enzyme beeinflussen, die Karzinogene blockieren, so erhöht es z. B. die Aktivität der Chinonreduktase, ein wichtiges Enzym bei Entgiftungsprozessen im Körper. Isothiocyanate aktivieren Phase-II-Enzyme. Aus heutiger Sicht ist das Gleichgewicht zwischen den karzinogenaktivierenden CYP-450-Phase-I- und den entgiftenden Phase-II-Enzymen einer der bestimmenden Faktoren in der Krebsentwicklung. Beim Menschen stehen Defizite der Phase-II-Enzymaktivität, insbesondere an Glutathion-S-Transferase (GST), eindeutig in Zusammenhang mit erhöhtem Risiko für Colon- und Lungenkrebs.
Isothiocyanate induzieren nachgewiesenermaßen Phase-II-Enzyme beim Nager und erhöhen die Glutathionspiegel im Gewebe. Erhalten die Tiere ein mit 3 bis 34 μmol/g Isothiocyanaten angereichertes Futter, steigen die GST- und Chinonreduktase-Spiegel im Schnitt um das zwei- bis vierfache in Geweben wie Nieren, Colon, Lunge oder Leber; aber auch Aktivitätssteigerungen bis zu neunfache wurden gefunden.[note]Literatur 62, 77, 101[/note] Dagegen scheinen die Wirkungen der Isothiocyanate auf Phase-I-Enzyme unterschiedlich einige werden gesteigert, andere vermindert.
Die etwa 20 natürlichen Isothiocyanate aus Nahrungspflanzen sind alle antikarzinogen wirksam. Ihr Potenzial hängt von Strukturelementen wie der Aromatensubstitution oder Kettenlänge ab. Außerdem ist eine Aktivitätsabhängigkeit im Bezug auf das Organ und Karzinogen festzustellen. So hemmen Benzyl- und Phenethylisothiocyanat (PEITC) besonders effizient die Entwicklung von Lungentumoren durch die Hauptkarzinogene des Tabakrauchs.
Phenethylisothiocyanat hemmt aber auch die Entwicklung von Ösophaguskrebs. Unter den natürlichen Isothiocyanaten nimmt Sulforaphan bereits strukturell eine Sonderstellung ein, da es mit der Sulfinylgruppe ein weiteres Schwefelatom enthält. Das große Interesse der medizinischen Forschung gründet jedoch darauf, dass es unter den getesteten Isothiocyanaten mit weitem Abstand das potenteste Antikarzinogen ist.[note]Literatur 6[/note]
Sulforaphan induziert mit am stärksten Phase-II-Enzyme und ist bereits im ppm-Bereich wirksam. Sein Einfluss auf Phase-I-Enzyme scheint ebenfalls günstig; zumindest wird das Karzinogen-aktivierende CYP 2E1 gehemmt. Sulforaphan blockiert sowohl die DMBA-induzierte Brusttumorbildung bei Ratten als auch die Bildung neoplastischer Knoten im Brustdrüsenpräparat der Maus.
2.3 Enorm vielseitiges Wirkspektrum
Nach heutigem Erkenntnisstand sind Glucosinolate die Prodrugs und Isothiocyanate die wichtigsten bioaktiven Stoffe mit einem enormen Wirkungsspektrum. Isothiocyanate werden vollständig resorbiert und hauptsächlich über die Nieren als Dithiocarbamate (N-Acetylcystein-Derivate) ausgeschieden. Kocht man die Pflanzen, wird die Myrosinase partiell oder komplett inaktiviert. Studien am Menschen mit Brunnenkresse ergaben, dass nur etwa 7 Prozent der aufgenommenen Glucosinolatmenge aus der gekochten Pflanze als Isothiocyanat ausgeschieden werden, dagegen bis zu 80 Prozent aus der rohen Pflanze.[note]Literatur 102[/note] Zu den markantesten Wirkungen der Isothiocyanate zählt ihr antibiotischer Effekt. Benzylsenföl wirkt noch in einer Verdünnung von 1:50000 antimikrobiell gegen Staphylococcus, Pseudomonas, Proteus sowie gegen Hautpilze. Bereits der Verzehr von etwa 10 Gramm Kapuziner- oder Gartenkresse sowie Meerrettich verleiht dem Urin bakteriostatische Eigenschaften. Pflanzenprodukte mit Benzylsenföl aber auch mit Allyl- und Phenethylisothiocyanaten (PEITC) werden daher seit langem mit Erfolg zur Adjuvanstherapie bei Infektionen der Atem- und Harnwege eingesetzt. Die tägliche Portion Kressesalat, mit Zitronensaft angemacht, ist gerade in Erkältungs-und Grippezeiten ein Vorbeugungsmittel der ersten Wahl. Da nach peroraler Gabe von Benzylisothiocyanat der Antikörpertiter steigt, dürfte die Stimulation unspezifischer Immunreaktionen hieran maßgeblich beteiligt sein.
Mehrere Isothiocyanate steigern die Sekretion und Motorik im Verdauungssystem, erhöhen das Herzschlagvolumen, wirken blutdrucksteigernd und lokal gefäßerweiternd, senken die Thrombozytenzahl oder aktivieren die Fibrinolyse. Meerrettich oder Senf können in größeren Portionen flushartige Symptome auslösen; nach zu großen Mengen Sauerkraut leiden empfindliche Personen mitunter an Durchfall. Andererseits sind einige dieser Effekte auch dafür verantwortlich, dass Krautwickel oder Sauerkraut lokal bei Furunkel oder Entzündungen besser abheilend wirken als manches etablierte Antiphlogistikum.

2.3 Mehr Rohkost und Sprossen
Das Nahrungsangebot an glucosinolathaltigen Pflanzen ist groß, wird aber im Westen nur ungenügend genutzt. Nach Untersuchungen nehmen Engländer täglich etwa 30 mg Glucobrassicin und 10 mg Indole zu sich, was auf eine sehr einseitige Gemüseselektion hindeutet.
Auch Deutsche schneiden nicht viel besser ab, obwohl sie im Ausland als Sauerkrautesser bekannt sind. Dagegen sind Japaner nicht nur bei Soja führend. Sie nehmen täglich mehr als 110 mg Glucosinolate zu sich, was für eine vielseitigere Ernährung spricht.
Da das spaltende Enzym Myrosinase beim Kochen zerstört wird, sollten Kohlgewächse besser gedünstet, blanchiert oder im Dampfgerät zubereitet werden. Noch wichtiger ist der Verzehr als Rohkost oder in Salaten, da dann die Isothiocyanate optimal zur Verfügung stehen.[note]Literatur 103[/note]
Vor allem sollten öfters Sprossen verzehrt werden, wegen ihres hohen Wirkstoffgehaltes können sie nicht nur Gemüse quantitativ ersetzen oder seine Auswahl variabler gestalten helfen, sie sind auch als Beilage und in Salaten eine interessante Geschmacksvariante.
Auch zur Risikominderung von Krebs liegen erste Ergebnisse vor. Bei Patienten mit oralen Tumoren wurde in einer Fall-Kontroll-Studie festgestellt, dass der Verzehr von Brassicaceen im Vergleich zu Personen, die solches Gemüse nicht konsumierten, das Risiko für Folgetumoren um 40 bis 60 Prozent mindert.[note]Literatur 104[/note] Auch zur Lungenkrebsprävention bei Rauchern sind Kombinationen von Benzylund Phenethylisothiocyanat beziehungsweise Brunnen- und Gartenkresse besonders aussichtsreiche Kandidaten. Zumindest sollte diese Möglichkeit bei Rauchern als Erfolg versprechende Präventivmaßnahme eingesetzt und empfohlen werden.
2.4 Indole besitzen nicht nur antioxidative Fähigkeiten
Auch die aus Glycosilaten entstehenden Indole haben nicht nur antioxidative Wirkungen, sie unterstützen auch das Immunsystem und haben eine nachgewiesene präventive Wirkung besonders bei Brustkrebs. Sie aktivieren schützende Enzyme, welche übermäßiges Östrogen, das an der Entstehung von Brustkrebs beteiligt ist, deaktivieren kann. Hier sind besonders 13 C und DIM interessant, da sie diese besonderen Fähigkeiten haben. Aber nicht nur für den onkologischen Bereich sind sie interessant. Sie können beispielsweise auch einige Symptome des chronischen Müdigkeits-Syndroms und der Fibromyalgie erleichtern.
13 C regt die endogene Bildung von Glutathion in Leberzellen (Hepatozyten) an und kann so eine Reihe toxischer Substanzen unschädlich machen wie z. B. Dioxin, Aflatoxin und die heterozyklischen aromatischen Amine. Diese Stoffe sind karzinogen da sie die DNA schädigen. 13 C verbindet sich gern mit Vitamin C zu Ascorbigen, ein weiteres wichtiges Indol.
Im Magen wird Indol-3-Carbinol zu DIM verstoffwechselt, das aus zwei verbundenen Molekülen von 13 C besteht. DIM hat eine um das 10-fache pro Milligramm höhere Wirkung als I3C. DIM kann die Verstoffwechselung toxischer Mykotoxine unterbinden. Wichtigste Eigenschaft ist aber, dass es die Umwandlung von Östron in eines seiner karzinogenen Metaboliten (16-Hydroxyöstron) reduziert, indem es dafür sorgt, dass Östron in seinen sicheren Metabolite (2-Hydroxyöstron) umgewandelt wird. 13 C und DIM hemmen auf diese Weise die Entwicklung vieler Krebsarten also nicht nur Brust-, sondern auch Darm- und Prostatakrebs.
2.5 Glucosinolate – in der Regel sicher in der Aufnahme
Glucosinolate und Indole sind in der Regel sicher in der Anwendung. Ein übermäßiger Konsum von Isothiocyanaten kann gelegentlich zu Gicht oder Schilddrüsen-Unterfunktion (Hypothyreose) führen, da es die Aufnahme von Jod hemmen kann und so die Funktion der Schilddrüse verringert. Schwangere Frauen sollten 13 C wegen seiner Wirkungen auf den Östrogenstoffwechsel nicht anwenden. Glucosinolate, vor allem Sulforaphan, und Indole sind in einigen Multi-Nährstoff-Präparaten enthalten. Dabei werden zur Nahrungsergänzung bzw. für präventive und therapeutische Zwecke vor allem Indole eingesetzt. Die Dosen reichen von 100 bis 300 mg täglich. 13 C und DIM werden auch als Monopräparate bzw. in speziellen Kombinationen angeboten. 13 C wird üblicherweise mit 400 bis 800 mg täglich dosiert. Die spezifischeren Dosierungen für Therapiezwecke richten sich nach dem Körpergewicht. DIM wird meist in Mengen von 100 bis zu 400 mg täglich angewendet.
3 Wie wirken die gesundheitsfördernden Inhaltsstoffe der Cruciferen?
Ist Krebs vielleicht eine Kohlmangelerkrankung, könnte man fragen. Es ist bekannt, dass eine Ursache dafür, dass immer mehr Menschen Krebs bekommen, vielleicht auch darin besteht, dass sie zu wenig Obst und Gemüse essen.[note]Literatur 1[/note] Nur ein geringer Teil der Deutschen isst die von der DGE empfohlenen „five a day“ zur optimalen Gesunderhaltung. Besonders bedenklich ist dies deshalb, da die Durchschnittskost der Deutschen einen großen Mangel an den wichtigen bioaktiven Stoffen hat, wie sie in Kreuzblütlern (Weiß-, Rot-, Grün-, Blumen-, Rosen- und Blumenkohl, Broccoli und Brunnenkresse) vorkommen. Kohlgemüse ist reich an Vitaminen, Mineralstoffen und Antioxidantien, die allesamt zur Gesunderhaltung beitragen. Darüber hinaus wurden besonders in Kohlgemüse sekundäre Pflanzenstoffe identifiziert, die für ihre Antikrebswirkung verantwortlich sind. Bei diesen Stoffen handelt es sich um Glucosinolate, die im Körper zum Indol-3-Carbinol (13 C) und Diindolylmethan (DIM) umgewandelt werden.[note]Literatur 17[/note]
Eine Ernährung, welcher diese Inhaltsstoffe von Kreuzblütlern fehlen, kann zur Krebsentstehung auf vielfältige Weise beitragen. Wir sind täglich größeren Mengen an Karzinogenen ausgesetzt. Kreuzblütler befähigen den Körper, diese Karzinogene zu neutralisieren.[note]Literatur 18-20[/note]
Ein wichtiger Anteil für die Krebsentstehung kommt auch von endogenen Produkten. Wenn beispielsweise Östron ungünstig metabolisiert wird, kann dies Krebs triggern.[note]Literatur 21, 22[/note] Ältere Menschen leiden auch deshalb an einer erhöhten Prävalenz für Krebs, da bei vielen ein gestörtes Gleichgewicht des Östrogenstoffwechsels vorliegt.[note]Literatur 21-24[/note] Kohlgemüse enthält Stoffe, die einen gesunden Östrogenstoffwechsel fördern und somit einen Schutz vor Krebs aufbauen.[note]Literatur 25-31[/note] Kohlgemüse wirkt aber über noch viel mehr Mechanismen, um vor Krebs zu schützen, als nur die positive Beeinflussung des Östrogenstoffwechsels.
3.1 Brunnenkresse: Ein wenig bekanntes Gemüse
Brunnenkresse gehört ebenfalls in die Gruppe der Cruciferen. Sie enthält reichlich die gegen Krebs wirksamen Stoffe Isothiacanate und Phenyl-Isothiocyanat (PEITC).[note]Literatur 68[/note]
Studien mit Broccoli/Brunnenkresseextrakten konnten zeigen, dass sie ein Enzym inaktivieren, das die Metastasierung von Brustkrebs unterstützt.[note]Literatur 69[/note] Die Isothiocanate der Brunnenkresse hemmen proinflammatorische Verbindungen wie z. B. die Prostaglandine, die bekanntlich mit einer Reihe von pathologischen Erscheinungen einschließlich Krebs einhergehen. Dieser antiinflammatorische Effekt ist also ein weiter Antikrebsmechanismus.[note]Literatur 70[/note] Sie fördern die Apoptose auch bei Zellen mit einem hohen Anteil des Proteins Bcl-2. Die besondere Gefahr des Bcl-2-Proteins liegt in der Tatsache, dass es Zellen gegenüber einer normalen Selbstzerstörung resistent macht. Da die Apoptose jedoch entscheidend ist für die Entfernung kranker Zellen aus dem Körper, kann man die Wertigkeit dieser bioaktiven Stoffe gar nicht hoch genug einschätzen. Auch unter dem Aspekt, dass eine Krebszelle mit einem hohen Bcl-2-Anteil eine erhöhte Resistenz gegenüber Zytostatika hat. Es konnte gezeigt werden, dass Bcl-2 die Krebszellen jedoch nicht gegen bestimmte Isothiocyanate schützen und insofern auch keine MDR aufbauen kann. Diese Erkenntnisse eröffnen neue Wege für die Entwicklung neuer Krebsmedikamente. Derartige Medikamente können den durch Bcl-2 aufgebauten Schutzmechanismus von Krebszellen durchbrechen und sie so für andere Behandlungen empfänglicher machen.
Es gibt Hinweise aus epidemiologischen Studien, dass bei erhöhter Aufnahme von Kohlgemüse das Risiko für Prostatakrebs reduziert ist. Besonders das Isothiocyanat PEITC inhibiert Prostatakrebszellen und ihre Fähigkeit, Tumoren zu bilden.[note]Literatur 71[/note] Brunnenkresse enthält viele Glucosinolate, u. a. Nasturiitin, das im Verdauungstrakt in PEITC umgewandelt wird.[note]Literatur 72[/note] In Tierversuchen konnte dieser bioaktive Stoff Lungenkrebs verhindern.[note]Literatur 73-76[/note] Die Entgiftung durch PEITC erfolgt über die Nieren. An einem humanen Leukämiemodel konnte gezeigt werden, dass Isocyanate an mehreren Targets angreifen, um Krebs zu regulieren.[note]Literatur 77[/note]
3.2 Die Neutralisierung ernährungs- und umweltbedingter Toxine
Östrogen-ähnliche Stoffe aus der Umwelt werden auch Xenoöstrogene genannt. Wir nehmen diese Xenoöstrogene aus Plastikflaschen, mit Industriechemikalien und Pestiziden auf.[note]Literatur 32, 33[/note] Im Körper sind diese Stoffe toxisch und können den Ausbruch oder das Fortschreiten von Krebs triggern. Dadurch, dass sie östrogenähnlich wirken, können Xenoöstrogene hormonregulierte Prozesse beeinflussen und die Wirkung von Wachstumsfaktoren verstärken.[note]Literatur 33[/note]
Ein Beispiel für teilweise toxisches Xenoöstrogen aus der Umwelt sind PCBs oder oolychlorierte Biphenyle. Zahlreiche Studien belegen, dass die polychlorierten Biphenyle einen negativen Einfluss auf die menschliche Gesundheit haben.[note]Literatur 34, 35, 38-41[/note] Gefährliche hohe Spiegel fanden sich besonders bei Kindern und Erwachsenem, die in Gegenden leben, in denen die Erde, das Wasser und die Luft mit diesen Chemikalien kontaminiert ist.[note]Literatur 34, 35[/note]
Alarmierend ist die Tatsache, dass sie immer wieder in der Nahrung gefunden werden, obwohl sie schon lange verboten sind, z. B. im Seelachs.[note]Literatur 36, 37[/note] Bei Männern, die viel Fisch essen, fand man nicht nur die höchsten PCB-Spiegel, sondern auch die höchste Inzidenz an Unfruchtbarkeit mit geringem Ejakulat, niedrigen Spermien und geringer Motilität.[note]Literatur 38, 39[/note] Es wird weiter vermutet, dass PCB auch für die zunehmende Anzahl von Allergien, Autoimmunerkrankungen und hormonabhängigen Krebsentitäten wie Mamma-, und Prostatakarzinom[note]Literatur 34, 35[/note] verantwortlich ist. PCB-Exposition kann auch die Hirnfunktion negativ beeinflussen und Gemütsschwankungen und Konzentrationsschwäche hervorrufen.[note]Literatur 40[/note] Eine erhöhte PCP-Exposition führt bei Frauen auch regelmäßig zum Auftreten einer Endometriose.[note]Literatur 41[/note]
Obwohl es fast unmöglich ist, eine Kontamination mit Xenoöstrogenen zu vermeiden, kann man jedoch sein persönliches Risiko durch einen erhöhten Verzehr gesundheitsfördernder sekundärer Pflanzenstoffe aus Kohlgemüse [note]Literatur 18-20[/note] reduzieren. Diese sekundären Pflanzenstoffe, in denen auch 13 C and andere Stoffe enthalten sind, erhöhen die Effektivität des primären Detoxifikationssystems die Leberenzyme der Phase I und Phase II.[note]Literatur 3, 42, 43, 78[/note] Diese Enzyme helfen dabei, gefährliche Karzinogene in harmlose Verbindungen zu überführen, die dann sicher aus dem Körper eliminiert werden.[note]Literatur 44-46[/note]
3.3 Rosmarin und Vitamin D weisen Synergismus bei der Krebsprävention auf
Carnosinsäure und Carnosol aus Rosmarin sind Antioxidantien, die wie I3C und DIM eine krebspräventive Wirkung haben.[note]Literatur 79[/note] Carnosinsäure und Carnosol reduzieren das karzinogene Potential der Östrogene durch Modulation des Leberstoffwechsels.[note]Literatur 80[/note] Diese Stoffe haben eine synergistische Wirkung mit Vitamin D. Vitamin D wird gerade intensiv beforscht hinsichtlich seiner wichtigen Bedeutung bei der Krebsbekämpfung. Dabei entpuppt sich Vitamin D als ein Differenzierungshormon, welches das Immunsystem moduliert und gegen Krebs wirkt.[note]Literatur 81-84[/note] Anstatt Krebszellen abzutöten, werden sie unter Einfluss von Vitamin D rückdifferenziert, so dass sie sich wieder wie normale Zellen verhalten.[note]Literatur 85, 86[/note] Neuste Untersuchungen konnten nun zeigen, dass sich Carnosolsäure bzw. Carnosol aus Rosmarin mit Vitamin D synergistisch verhalten und Krebszellen effektiver abgetötet werden.[note]Literatur 85-87[/note] Diese Kombination von Rosmarin und Vitamin D stellt eine neue Kombination für Krebstherapie dar und sollte besonders älteren Menschen empfohlen werden.
3.4 Gesunden Östrogenstoffwechsel fördern
Wie bereits betont, kann eine Störung des Östrogenstoffwechsels besonders im höheren Alter krebsfördend wirken.[note]Literatur 21-24[/note] Östradiol ist das primär im Körper zirkulierende Östrogen, aber auch das wirksamste. Der Körper metabolisiert Östradiol über zwei Stoffwechselwege (Abb. 2). Ein Stoffwechselweg führt zu einer weniger potenten Form des Östrogens (2-Hydrox-Östron), während der andere Stoffwechselweg die Bildung des toxischen Metaboliten 16-AlphaHydroxy-Östron fördert. Es ist bekannt, dass Frauen, die überwiegend Östrogen zu 16-Alpha-Hydroxy-Östron metabolisieren, ein höheres Risiko haben Brustkrebs zu entwickeln.[note]Literatur 25[/note]
Seit etwa dem Jahr 2000 ist endgültig bestätigt, dass bestimmte Östrogenmetabolite zur Krebsentwicklung beitragen. Wie sich diätetische und hormonale Einflüsse auf das Krebsrisiko auswirken, ergab eine Analyse von 10.000 Italienerinnen, die über fünf Jahre beobachtet wurden. Frauen, die einen höheren Spiegel an dem weniger potenten 2-Hydroxyöstron hatten, entwickelten auch seltener Krebs.[note]Literatur 25[/note] Weitere Studien an verschiedenen Bevölkerungsgruppen haben dies seither bestätigt. Ein günstiges Verhältnis der Östrogenmetabolite wird jetzt generell als guter Krebsschutz angesehen.[note]Literatur 21, 47, 48[/note] Der toxische Metabolit 16-Alpha-Hydroxyöstron kann als Tumorpromoter agieren.[note]Literatur 21[/note] Im Gegensatz zu dem weniger aktiven 2-Hydroxyöstron, das keine Östrogenwirkung im Brustgewebe hat.[note]Literatur 21[/note] Darüber hinaus wirkt dieser weniger aktive Östrogenmetabolit auch auf die Angiogenese ein und hilft auch auf diese Weise, ein Tumorwachstum zu verhindern.[note]Literatur 49[/note]
Diese empfindliche Balance des Östrogenmetabolismus ist auch wichtig für die Gesundheit von Männern. Studien an Männern, in denen die Ration 16-Alpha-Hydroxyöstron versus 2-Hydroxyöstron analysiert wurde, konnten zeigen, dass das relative Risiko an Prostatakarzinom zu erkranken, mit dem ungünstigen 16-Alpha Hydroxyöstron vergesellschaftet ist. Dieser wichtige Befund legt nahe, dass auch bei Männern das Verhältnis der Östrogenmetabolite eine große Bedeutung für die Entwicklung des Prostatakarzinoms hat.[note]Literatur 22[/note]
Glücklicherweise beeinflussen die Inhaltsstoffe 13 C und DIM der Kreuzblütler den Östrogenstoffwechsel günstig, indem sie das toxische 16-Alpha-Hydroxyöstron absenken und das vorteilhafte 2-Hydroxyöstron anheben und so ein günstiges Verhältnis der beiden herstellen.[note]Literatur 26-31[/note] Diese günstige Hormonmodulation des Östrogenstoffwechsels ist aber nicht nur assoziiert mit einem reduzierten Brustkrebsrisiko, sondern auch mit anderen Karzinomentitäten wie Zervix-, Prostata-, und sogar mit HNO-Karzinomen.[note]Literatur 15, 19, 21, 25, 30, 31, 50, 52[/note] Kohlgemüse bzw. deren Inhaltsstoffe spielen damit eine bedeutende Rolle bei der Reduktion des Karzinomrisikos, indem sie einen gesunden Östrogenstoffwechsel fördern.
3.4 Gebratenes Fleisch erhöht das Krebsrisiko
Fleisch, das bei hohen Temperaturen gebraten wurde, ist eine der Hauptquellen für Karzinogene. Besonders dann, wenn es scharf gebraten wurde, enthält es viele toxische Substanzen, einschließlich heterozyklischer Amine.[note]Literatur 97[/note] Von diesen Stoffen ist bekannt, dass sie DNS-Mutationen im Tiermodel bewirken.[note]Literatur 95, 96, 98[/note] Dass übermäßiger Fleischgenuss zu erheblichen Gesundheitsschäden einschließlich Krebs führt, habe ich schon 1986 ausgeführt.[note]Literatur 96[/note] Epidemiologische Studien haben nämlich gezeigt, dass der regelmäßige Verzehr von gebratenem Fleisch mit einer Inzidenz an Kolon-, Mamma-, und Magenkrebs einhergeht.[note]Literatur 97[/note] Bei Männern wurde ein Zusammenhang mit dem gehäuften Auftreten von Prostatakrebs gezeigt. Interessanterweise ist es nicht die Menge von rotem oder weißem Fleisch, die den Prostatakrebs verursacht, sondern ob es gebraten ist oder nicht. Es sind nämlich die heterozyklischen Amine, die das Risiko an Prostatakrebs zu erkranken, erhöhen.[note]Literatur 98[/note] Während heterozyklische Amine selbst gar nicht karzinogen sind, werden sie im Organismus zu chemischen Stoffen transformiert, die mit der DNS interagieren und so die Krebsentwicklung initiieren.[note]Literatur 97[/note]
Es ist daher keine falsche Annahme, dass es möglich ist, durch eine gesunde Ernährung und durch die regelmäßige Einnahme von Nahrungsergänzungsmitteln das persönliche Krebsrisiko erheblich zu senken. Schützende Stoffe aus Kreuzblütlern können besonders dazu beitragen, die Karzinogene aus Fleisch zu neutralisieren und zu entgiften.[note]Literatur 1, 98[/note]
3.5 Wie kann man die Vorteile von Kohlgemüse am besten nutzen?
Während der Gesundheitswert der aktiven Stoffe aus Kreuzblütlern für unsere Gesundheit weitgehend akzeptiert ist, ist es aber schwierig, die richtigen Mengen zu finden, zumal es ja schon schwierig sein kann, die erforderlichen Mengen für eine Schutzwirkung allein durch eine gesunde Ernährung zu erreichen.[note]Literatur 53, 54[/note] Untersuchungen haben zudem gezeigt, dass, selbst wenn man täglich Kohlgemüse essen würde, dies nicht ausreicht, da während der Lagerung und dem Kochen viele der gesundheitsfördernden Glycosilate verloren gehen können. Mehr noch, das Kochen von Kohlgemüse kann sogar die Umwandlung der meisten Glycosilate inhibieren, sodass ihre vorteilhafte Antikrebswirkung verloren geht.[note]Literatur 53, 54[/note]
Um aber die gesundheitlichen Vorteile und insbesondere die Antikrebswirkung allen zugänglich zu machen, wurden die Inhaltsstoffe isoliert und die wichtigsten in Nahrungsergänzungsmitteln zusammengestellt. Krebs bekämpfende Pflanzenstoffe werden am besten mit den Mahlzeiten konsumiert, wobei sie helfen, die mit der Nahrung assoziierten Karzinogene zu neutralisieren.
4 Zusammenfassung
Es ist schon erstaunlich, dass offensichtlich die in jedem Supermarkt erhältlichen Gemüse und Kräuter die potentesten Antikrebsmittel enthalten, die die Natur hervorbringt.[note]Literatur 55-67[/note]
Natürliche, sekundäre Pflanzenstoffe aus Kreuzblütlern wie sie z. B. in Blumen-, Weiß-, Grün-, Rotkohl, Broccoli und Brunnenkresse vorkommen, können gemeinsam mit hoch wirksamen Antioxidantien wie Polyphenolen (z. B. Carnosinsäure und Carnoslo aus Rosmarin) unsere Gesundheit nachhaltig schützen. Sie fördern einen gesunden Östrogen-Stoffwechsel, wirken antikarzinogen, antioxidativ, immunmodulierend und detoxifizierend und fördern so nicht nur die Gesundheit, sondern senken auch ganz erheblich das Risiko, an Krebs zu erkranken. Somit sind sie auch für die Sekundärprophylaxe nach der Primärtherapie geeignet.Die regelmäßige Einnahme dieser hochpotenten Pflanzenstoffe mit der täglichen Nahrung in Form von Nahrungsergänzungsmitteln ist effektiv und billig, da sie zweifellos dazu beitragen kann, die häufigsten letalen Krebsarten zu verhindern.
Literatur
- Weisburger JH. Antimutagens, anticarcinogens, and effective worldwide cancer prevention. J Environ Pathol Toxicol Oncol. 1999;18(2):85-93.
- Aggarwal BB, Ichikawa H. Molecular targets and anticancer potential of indole-3carbinol and its derivatives. Cell Cycle. 2005 Sep;4(9):1201-15.
- Sarkar FH, Li Y. Indole-3-carbinol and prostate cancer. J Nutr. 2004 Dec;134(12 Suppl):3493S-8S.
- Plate AY, Gallaher DD. Effects of indole-3-carbinol and phenethyl isothiocyanate on colon carcinogenesis induced by azoxymethane in rats. Carcinogenesis. 2006 Feb;27(2):287-92.
- Tadi K, Chang Y, Ashok BT, et al. 3,3′-Diindolylmethane, a cruciferous vegetable derived synthetic anti-proliferative compound in thyroid disease. Biochem Biophys Res Commun. 2005 Nov 25;337(3):1019-25.
- Kim YS, Milner JA. Targets for indole-3-carbinol in cancer prevention. J Nutr Biochem. 2005 Feb;16(2):65-73.
- Brew CT, Aronchik I, Hsu JC, et al. Indole-3-carbinol activates the ATM signaling pathway independent of DNA damage to stabilize p53 and induce Gl arrest of human mammary epithelial cells. Int J Cancer. 2006 Feb 15;118(4):857-68.
- Chang X, Tou JC, Hong C, et al. 3,3′-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice. Carcinogenesis. 2005 Apr;26(4):771.
- Manson MM, Farmer PB, Gescher A, Steward WP. Innovative agents in cancer prevention. Recent Results Cancer Res . 2005;166:257-75.
- Shukla Y, Kalra N, Katiyar S, Siddiqui IA, Arora A. Chemopreventive effect of indole-3-carbinol on induction of preneoplastic altered hepatic foci. Nutr Cancer. 2004;50(2):214-20.
- Garikapaty VP, Ashok BT, Chen YG, et al. Anti-carcinogenic and anti-metastatic properties of indole-3-carbinol in prostate cancer. Oncol Rep. 2005 Jan;13(l):89-93.
- Rahman KW, Sarkar FH. Inhibition of nuclear translocation of nuclear factor{kappa}B contributes to 3,3′-diindolylmethane-induced apoptosis in breast cancer cells. Cancer Res. 2005 Jan 1;65(1):364-71.
- Qi M, Anderson AE, Chen DZ, Sun S, Auborn KJ. Indole-3-carbinol prevents PTEN loss in cervical cancer in vivo. Mol Med. 2005 Jan;l l(l-12):59-63.
- Bonnesen C, Eggleston IM, Hayes JD. Dietary indoles and isothiocyanates that are generated from cruciferous vegetables can both stimulate apoptosis and confer protection against DNA damage in human colon cell lines. Cancer Res. 2001 Aug 15;61(16):6120-30.
- Fowke JH, Chung FL, Jin F, et al. Urinary isothiocyanate levels, brassica, and human breast cancer. Cancer Res. 2003 Jul 15;63(14):3980-6.
- Li Y, Chinni SR, Sarkar FH. Selective growth regulatory and pro-apoptotic effects of DIM is mediated by AKT and NF-kappaB pathways in prostate cancer cells. Front Biosci. 2005 Jan l;10:236-43.
- Nachshon-Kedmi M, Yannai S, Haj A, Fares FA. Indole-3-carbinol and 3,3’diindoylemethane induce apoptosis in human prostate cancer cells. Food Chem Toxicol. 2003 Jun;41(6):745-52.
- Rogan EG. The natural chemopreventive compound indole-3-carbinol: State of the science. In Vivo. 2006 Mar;20(2):221-8.
- Kristal AR, Lampe JW. Brassica vegetables and prostate cancer risk: a review of the epidemiological evidence. Nutr Cancer. 2002;42(l):l-9.
- Fowke JH, Morrow JD, Motley S, Bostick RM, Ness RM. Brassica vegetable consumption reduces urinary F2-isoprostane levels independent of micronutrient intake. Carcinogenesis. 2006 May 15.
- Fowke JH, Longcope C, Hebert JR. Brassica vegetable consumption shifts estrogen metabolism in healthy postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2000 Aug;9(8):773-9.
- Muti P, Westerlind K, Wu T, et al. Urinary estrogen metabolites and prostate cancer: a case-control study in the United States. Cancer Causes Control. 2002 Dec;13(10):94755.
- Available at: http://www.cancer.gov/cancertopics/factsheet/Detection/probabilitybreast-cancer. Accessed July 26, 2006.
- Available at: . Accessed July 26, 2006.
- Muti P, Bradlow HL, Micheli A, et al. Estrogen metabolism and risk of breast cancer: a prospective study of the 2:16alpha-hydroxyestrone ratio in premenopausal and postmenopausal women. Epidemiology. 2000 Nov;ll(6):635-40.
- Michnovicz JJ, Adlercreutz H, Bradlow HL. Changes in levels of urinary estrogen metabolites after oral indole-3-carbinol treatment in humans. J Natl Cancer Inst. 1997 May21;89(10):718-23.
- Michnovicz JJ. Increased estrogen 2-hydroxylation in obese women using oral indole-3-carbinol. Int J Obes Relat Metab Disord. 1998 Mar;22(3):227-9.
- Michnovicz JJ, Bradlow HL. Altered estrogen metabolism and excretion in humans following consumption of indole-3-carbinol. Nutr Cancer. 1991;16(l):59-66.
- Kali MA, Vang O, Clausen J. Effects of dietary broccoli on human drug metabolising activity. Cancer Lett. 1997 Mar 19;114(l-2):169-70.
- Bradlow HL, Telang NT, Sepkovic DW, Osborne MP. 2-hydroxyestrone: the ‚good‘ estrogen. J Endocrinol. 1996 Sep;150 SupplS259-65.
- Dalessandri KM, Firestone GL, Fitch MD, Bradlow HL, Bjeldanes LF. Pilot study: effect of 3,3′-diindolylmethane Supplements on urinary hormone metabolites in postmenopausal women with a history of early-stage breast cancer. Nutr Cancer. 2004;50(2):161-7.
- Available at: . Accessed July 26, 2006.
- Starek A. Estrogens and organochlorine xenoestrogens and breast cancer risk. Int J Med Environ Health. 2003;16(2):l 13-24.
- Inadera H. The immune System as a target for environmental chemicals: Xenoestrogens and other compounds. Toxicol Lett. 2006 Jul 15; 164(3): 191-206.
- DeCastro BR, Korrick SA, Spengler JD, Soto AM. Estrogenic activity of polychlorinated biphenyls present in human tissue and the environment. Environ Sei Technol. 2006 Apr 15;40(8):2819-25.
- Burreau S, Zebuhr Y, Broman D, Ishaq R. Biomagnification of PBDEs and PCBs in food webs from the Baltic Sea and the northern Atlantic Ocean. Sei Total Environ. 2006 Mar 29.
- Johnson-Restrepo B, Kaiman K, Addink R, Adams DH. Polybrominated diphenyl ethers and polychlorinated biphenyls in a marine foodweb of coastal Florida. Environ Sei Technol. 2005 Nov l;39(21):8243-50.
- Rozati R, Reddy PP, Reddanna P, Mujtaba R. Role of environmental estrogens in the deterioration of male factor fertility. Fertil Steril. 2002 Dec;78(6): 1187-94.
- Hauser R, Chen Z, Pothier L, Ryan L, Altshul L. The relationship between human semen parameters and environmental exposure to polychlorinated biphenyls and p,p’DDE. Environ Health Perspect. 2003 Sep;l 1 l(12):1505-l 1.
- Peper M, Klett M, Morgenstern R. Neuropsychological effects of chronic low-dose exposure to polychlorinated biphenyls (PCBs): a cross-sectional study. Environ Health. 2005 ;422.
- Louis GM, Weiner JM, Whitcomb BW, et al. Environmental PCB exposure and risk of endometriosis. Hum Reprod. 2005 Jan;20(l):279-85.
- Bradfield CA, Bjeldanes LF. Modification of carcinogen metabolism by indolylic autolysis produets of Brassica oleraceae. Adv Exp Med Biol. 1991;289:153-63.
- Nho CW, Jeffery E. The synergistic upregulation of phase II detoxification enzymes by glucosinolate breakdown products in cruciferous vegetables. Toxicol Appl Pharmacol. 2001 Jul 15; 174(2): 146-52.
- Leibelt DA, Hedstrom OR, Fischer KA, Pereira CB, Williams DE. Evaluation of chronic dietary exposure to indole-3-carbinol and absorption-enhanced 3,3’diindolylmethane in sprague-dawley rats. Toxico Sei. 2003 Jul;74(l): 10-21.
- Crowell JA, Page JG, Levine BS, Tomlinson MJ, Hebert CD. Indole-3-carbinol, but not its major digestive produet 3,3′-diindolylmethane, induces reversible hepatocyte hypertrophy and cytochromes P450. Toxicol Appl Pharmacol. 2006 Mar 1;211(2):11523.
- Larsen-Su S, Williams DE. Dietary indole-3-carbinol inhibits FMO activity and the expression of flavin-containing monooxygenase form 1 in rat liver and intestine. Drug Metab Dispos. 1996 Sep;24(9):927-31.
- Ho GH, Luo XW, Ji CY, Foo SC, Ng EH. Urinary 2/16 alpha-hydroxyestrone ratio: correlation with serum insulin-like growth factor binding protein-3 and a potential biomarker of breast cancer risk. Ann Acad Med Singapore. 1998 Mar;27(2):294-9.
- Meng Q, Yuan F, Goldberg ID, et al. Indole-3-carbinol is a negative regulator of estrogen receptor-alpha signaling in human tumor cells. J Nutr. 2000 Dec;130(12):292731.
- Fowke JH, Qi D, Bradlow HL, et al. Urinary estrogen metabolites and breast cancer: differential pattern of risk found with pre- versus post-treatment collection. Steroids. 2003 Jan;68(l):65-72.
- Wong GY, Bradlow L, Sepkovic D, et al. Dose-ranging study of indole-3-carbinol for breast cancer prevention. J Cell Biochem Suppl. 1997;28-29:111-6.
- Yoo HJ, Sepkovic DW, Bradlow HL, Yu GP, Sirilian HV, Schantz SP. Estrogen metabolism as a risk factor for head and neck cancer. Otolaryngol Head Neck Surg. 2001 Mar;124(3):241-7.
- Jin L, Qi M, Chen DZ, et al. Indole-3-carbinol prevents cervical cancer in human papilloma virus type 16 (HPV16) transgenic mice. Cancer Res. 1999 Aug 15;59(16):3991-7.
- Fahey JW, Zalcmann AT, Talalay P. The chemical diversity and distribution of glucosinolates and isothioeyanates among plants. Phytochemistry. 2001 Jan;56(l):5-51.
- Rouzaud G, Young SA, Duncan AJ. Hydrolysis of glucosinolates to isothioeyanates after ingestion of raw or microwaved cabbage by human volunteers. Cancer Epidemiol Biomarkers Prev. 2004 Jan;13(l):125-31.
- Garikapaty VP, Ashok BT, Tadi K, Mittelman A, Tiwari RK. 3,3′-Diindolylmethane downregulates pro-survival pathway in hormone independent prostate cancer. 92145. Staub RE, Onisko B, Bjeldanes LF. Fate of 3,3′-diindolylmethane in eultured MCF-7 human breast cancer cells. Chem Res Toxicol. 2006 Mar;19(3):436-442.
- Staub RE, Onisko B, Bjeldanes LF, et al. Fate of 3,3′ diindolylmethane in cultured MCF-7 human breast cancer cells. Chem Res Toxicol. 2006 Mar;19(3):436-42.
- Naik R, Nixon S, Lopes A, et al. A randomized phase II trial of indole-3-carbinol in the treatment of vulvar intraepithelial neoplasia. Int J Gynecol Cancer. 2006 Mar;16(2):786-90.
- Riby JE, Xue L, Chatterji U, et al. Activation and potentiation of interferon-gamma signaling by 3,3′-diindolylmethane in MCF-7 breast cancer cells. Mol Pharmacol. 2006 Feb;69(2):430-9.
- Wallig MA, Heinz-Taheny KM, Epps DL, Gossman T. Synergy among phytochemicals within crucifers: does it translate into chemoprotection? J Nutr. 2005 Dec;135(12 Suppl):2972S-7S.
- Keum YS, Jeong WS, Kong AN. Chemopreventive functions of isothiocyanates. DrugNews Perspect. 2005 Sep;18(7):445-51.
- Lynn A, Collins A, Füller Z, Hillman K, Ratcliffe B. Cruciferous vegetables and colorectal cancer. Proc Nutr Soc. 2006 Feb;65(l):135-44.
- Zhang Y, Yao S, Li J. Vegetable-derived isothiocyanates: anti-proliferative activity and mechanism of action. Proc Nutr Soc. 2006 Feb;65(l):68-75.
- Halkier BA, Gershenzon J. Biology and biochemistry of glucosinolates. Annu Rev Plant Biol. 2006 Jun 2;57:303-33.
- Moreno DA, Carvajal M, Lopez-Berenguer C, Garcia-Viguera C. Chemical and biological characterisation of nutraceutical compounds of broccoli. J Pharm Biomed Anal. 2006 May 17.
- Gong Y, Sohn H, Xue L, Firestone GL, Bjeldanes LF. 3,3′-Diindolylmethane is a novel mitochondrial H(+)-ATP synthase inhibitor that can induce p21(Cipl/Wafl) expression by induction of oxidative stress in human breast cancer cells. Cancer Res. 2006 May l;66(9):4880-7.
- Perocco P, Bronzetti G, Canistro D, et al. Glucoraphanin, the bioprecursor of the widely extolled chemopreventive agent sulforaphane found in broccoli, induces phase-I xenobiotic metabolizing enzymes and increases free radical generation in rat liver. Mutat Res. 2006 Mar 20;595(l-2):125-36.
- Hanf V, Gonder U. Nutrition and primary prevention of breast cancer: foods, nutrients and breast cancer risk. Eur J Obstet Gynecol Reprod Biol. 2005 Dec ‚ l;123(2):139-49.
- Rose P, Faulkner K, Williamson G, Mithen R. 7-Methylsulfinylheptyl and 8methylsulfinyloctyl isothiocyanates from watercress are potent inducers of phase II enzymes. Carcinogenesis. 2000 Nov;21(ll): 1983-8.
- Rose P, Huang Q, Ong CN, Whiteman M. Broccoli and watercress suppress matrix metalloproteinase-9 activity and invasiveness of human MDA-MB-231 breast cancer cells. Toxicol Appl Pharmacol. 2005 Dec l;209(2):105-13.
- Rose P, Won YK, Ong CN, Whiteman M. Beta-phenylethyl and 8methylsulphinyloctyl isothiocyanates, constituents of watercress, suppress LPS induced production of nitric oxide and prostaglandin E2 in RAW 264.7 macrophages. Nitric Oxide. 2005 Jun;12(4):237-43.
- Chiao JW, Wu H, Ramaswamy G, et al. Ingestion of an isothiocyanate metabolite from cruciferous vegetables inhibits growth of human prostate cancer cell xenografts by apoptosis and cell cycle arrest. Carcinogenesis. 2004 Aug;25(8): 1403-8.
- Palaniswamy UR, McAvoy RJ, Bible BB, Stuart JD. Ontogenic variations of ascorbic acid and phenethyl isothiocyanate concentrations in watercress (Nasturtium officinale R.Br.) leaves. J Agric Food Chem. 2003 Aug 27;51(18):5504-9.
- Hecht SS, Chung FL, Richie JP, Jr., et al. Effects of watercress consumption on metabolism of a tobacco-specific hing carcinogen in smokers. Cancer Epidemiol Biomarkers Prev. 1995 Dec;4(8):877-84.
- Hecht SS. Chemoprevention by isothiocyanates. J Cell Biochem Suppl. 1995;22:195-209.
- Jiao D, Smith TJ, Yang CS, et al. Chemopreventive activity of thiol conjugates of isothiocyanates for lung tumorigenesis. Carcinogenesis. 1997 Nov;18(ll):2143-7.
- Sticha KR, Kenney PM, Boysen G, et al. Effects of benzyl isothiocyanate and phenethyl isothiocyanate on DNA adduct formation by a mixture of benzo[a]pyrene and 4-(methylnitrosamino)-l-(3-pyridyl)-l-butanone in A/J mouse lung. Carcinogenesis. 2002 Sep;23(9): 1433-39.
- Zhang Y, Tang L, Gonzalez V. Selected isothiocyanates rapidly induce growth inhibition of cancer cells. Mol Cancer Ther. 2003 Oct;2(10): 1045-52.
- Lhoste EF, Gloux K, De W, I, et al. The activities of several detoxication enzymes are differentially induced by Juices of garden cress, water cress and mustard in human HepG2 cells. Chem Biol Interact. 2004 Dec 7;150(3):211-9.
- Offord EA, Mace K, Avanti O, Pfeifer AM. Mechanisms involved in the chemoprotective effects of rosemary extract studied in human liver and bronchial cells. Cancer Lett. 1997 Mar 19;114(l-2):275-81.
- Zhu BT, Loder DP, Cai MX, et al. Dietary administration of an extract from rosemary leaves enhances the liver microsomal metabolism of endogenous estrogens and decreases their uterotropic action in CD-1 mice. Carcinogenesis. 1998 Oct;19(10):1821-7.
- Pinette KV, Yee YK, Amegadzie BY, Nagpal S. Vitamin D receptor as a drug discovery target. Mini Rev Med Chem. 2003 May;3(3): 193-204.
- Bao BY, Yeh SD, Lee YF. lalpha,25-dihydroxyvitamin D3 inhibits prostate cancer cell invasion via modulation of selective proteases. Carcinogenesis. 2006 Jan;27(l):3242.
- Tangpricha V, Flanagan JN, Whitlatch LW, et al. 25-hydroxyvitamin D-lalphahydroxylase in normal and malignant colon tissue. Lancet. 2001 May 26;357(9269): 1673-4.
- Yee YK, Chintalacharuvu SR, Lu J, Nagpal S. Vitamin D receptor modulators for inflammation and cancer. Mini Rev Med Chem. 2005 Aug;5(8):761-78.
- Danilenko M, Wang Q, Wang X, et al. Carnosic acid potentiates the antioxidant and prodifferentiation effects of lalpha,25-dihydroxyvitamin D3 in leukemia cells but does not promote elevation of basal levels of intracellular calcium. Cancer Res. 2003 Mar 15;63(6):1325-32.
- Danilenko M, Studzinski GP. Enhancement by other compounds of the anti-cancer activity of vitamin D(3) and its analogs. Exp Cell Res. 2004 Aug 15;298(2):339-58.
- Steiner M, Priel I, Giat J, et al. Carnosic acid inhibits proliferation and augments differentiation of human leukemic cells induced by 1,25-dihydroxyvitamin D3 and retinoic acid. Nutr Cancer. 2001;41(l-2):135-44.
- Keplinger K, Laus G, Wurm M, Dierich MP, Teppner H. Uncaria tomentosa (Willd.) DC.-ethnomedicinal use and new pharmacological, toxicological and botanical results. J Ethnopharmacol. 1999 Jan;64(l):23-34.
- Riva L, Coradini D, Di Fronzo G, et al. The antiproliferative effects of Uncaria tomentosa extracts and fractions on the growth of breast cancer cell line. Anticancer Res. 2001 Jul-Aug;21(4A):2457-61.
- Sheng Y, Bryngelsson C, Pero RW. Enhanced DNA repair, immune function and reduced toxicity of C-MED-100, a novel aqueous extract from Uncaria tomentosa. J Ethnopharmacol. 2000 Feb;69(2): 115-26.
- Sheng Y, Li L, Holmgren K, Pero RW. DNA repair enhancement of aqueous extracts of Uncaria tomentosa in a human volunteer study. Phytomedicine. 2001 Jul;8(4):275-82.
- Bacher N, Tiefenthaler M, Sturm S, et al. Oxindole alkaloids from Uncaria tomentosa induce apoptosis in proliferating, GO/Gl-arrested and bcl-2-expressing acute lymphoblastic leukaemia cells. Br J Haematol. 2006 Mar;132(5):615-22.
- Spellman K, Burns J, Nichols D, Winters N, Ottersberg S, Tenborg M. Modulation of cytokine expression by traditional medicines: a review of herbal immunomodulators. Altern Med Rev. 2006 Jun;l 1(2): 128-50.
- Hayakawa Y, Smyth MJ. Innate immune recognition and suppression of tumors. Adv Cancer Res. 2006;95:293-322.
- Sinha R, Peters U, Cross AJ, et al. Meat, meat cooking methods and preservation, and risk for colorectal adenoma. Caneer Res. 2005 Sep l;65(17):8034-41.
- Douwes F.R. Gesundheit – aktives Aufgabenfeld. Beiträge zur Lebensführung für gesunde und Kranke, vfm Verlag für Medizin Dr. Ewald Fischer. Heidelberg 1986.
- Wogan GN, Hecht SS, Feiton JS, Conney AH, Loeb LA. Environmental and chemical carcinogenesis. Semin Caneer Biol. 2004 Dec;14(6):473-86.
- Cross AJ, Peters U, Kirsh VA, et al. A prospective study of meat and meat mutagens and prostate caneer risk. Caneer Res. 2005 Decl5;65(24):l 1779-84.
- Steinkellner H, Rabot S, Freywald C, et al. Effects of crueiferous vegetables and their constituents on drug metabolizing enzymes involved in the bioactivation of DNAreactive dietary carcinogens. Mutat Res. 2001 Sep l;480-481:285-97.
- Steven Schwartz (Staatsuniversität von Ohio, Columbus) et al.: Präsentation bei Lebensmitteltechnologen-Treffen des IFT in New Orleans.
- Zhang, Y., Talalay, P., Anticarcinogenic activities of organic isothioeyanates: chemistry and mechanisms. Caneer Res. 54 (1994), SuppL, 1976s – 1981s.
- Getahun, S. M., Chung, F. L., Conversion of glucosinolates to isothioeyanates in humans after ingestion of cooked watercress. Caneer Epidem. Biomark. Prev. 8 (1999) 447-451.
- Shapiro, T. A., et al., Human metabolism and exeretion of caneer chemoprotective glucosinolates and isothioeyanates of crueiferous.
- Day, G. L., et al., Dietary factors and secondary primary cancers: a follow-up on oral and pharyngeal caneer patients. Nutr. Caneer 21 (1994) 223 – 232.ben wie Nieren, Colon, Lunge oder Leber; aber auch Aktivitätssteigerungen bis zu neunfache wurden gefunden (62, 77,101).



